原标题:姜博士论文
08142013-Nature-Article-shutdown-chromosome
Title: Translating dosage compensation to trisomy21
题目:对于21号染色体三体性的翻译剂量补偿
Abstract: Down’s syndrome is a common disorder with enormous medical and social costs, caused by trisomy for chromosome 21. We tested the concept that gene imbalance across an extra chromosome can be de facto corrected by manipulating a single gene, XIST (the X-inactivation gene). Using genome editing with zinc finger nucleases, we inserted a large, inducible XISTtransgene into the DYRK1A locus on chromosome 21, in Down’s syndrome pluripotent stem cells. The XIST non-coding RNA coats chromosome 21 and triggers stable heterochromatin modifications, chromosome-wide transcriptional silencing and DNA methylation to form a ‘chromosome 21 Barr body’. This provides a model to study human chromosome inactivation and creates a system to investigate genomic expression changes and cellular pathologies of trisomy 21, free from genetic and epigenetic noise. Notably, deficits in proliferation and neural rosette formation are rapidly reversed upon silencing one chromosome 21. Successful trisomy silencing in vitro also surmounts the major first steptowards potential development of ‘chromosome therapy’.
摘要: 唐氏综合症是一种常见疾病,需要消耗大量的医疗方面及社会福利保障方面的财政支出,这一疾病是由21号染色体的三体性造成的。有这样一个概念,即基因由于一个多余的染色体而造成的不平衡可以通过一个单基因XIST(X-失活基因)的操作而得到实质性的修正。使用锌指核酸酶对基因组的编辑功能,我们在唐氏综合症万能干细胞21号染色体的DYRK1A位点上插入一个大的可诱导的XIST转基因。基因XIST的非编码RNA覆盖21号染色体并促进稳定的异源染色质修饰作用,染色体范围的转录沉默及DNA甲基化作用以形成“21号染色体巴氏小体”。这一结果为研究人染色体失活提供了一个模型并为21号染色体三体的基因组表达改变及细胞病理学的研究创造了一个系统,同时不带有任何遗传性或表观遗传性背景。值得注意的是,当我们对一个21号染色体进行沉默后,增殖和神经丛的缺陷被迅速地逆转了。体外水平染色体三体成功的沉默还显示出向可能形成的“染色体治疗”方法迈出了重要的第一步。
在美国,大约每300个新生儿中就有一例染色体三体,而这其中的一半是21号染色体三体,这是导致唐氏综合症的原因。唐氏综合症是导致智力缺陷的首位遗传性因素,而全世界各地无数的唐氏综合症患者还面临多种其它健康问题,包括先天性心脏缺陷,造血类疾病以及早发类阿兹海默症。唐氏综合症的研究人员已经在21号染色体上搜寻判定那些与唐氏综合症最相关的基因,但由于高度的遗传复杂性和唐氏综合症表型的多变性以及个体之间正常变化的混淆使得这项工作非常困难。虽然在唐氏综合症的小鼠模型上取得了一些进展,但对于人类唐氏综合症的细胞及发育的病理学内容还是需要找到更好的方法来理解,这是任何种类治疗方式设计的关键。
在过去的十年间,人们在对于罕见的单遗传性疾病的单基因缺陷的修正策略方面取得了很大的进展,这些研究起始于体外的细胞水平,在其中的几项研究工作中已经进展到体内和临床测试的水平。相反,在染色体三体细胞中对于整个一个多余染色体的基因过量的遗传性修正还停留在可能性之外。我们的工作基于一种观念即活体染色体三体细胞的功能性修正可能会通过将一个可以表观遗传性沉默整个染色体的单基因的插入而变为可能。对于这种“三体性沉默”来说一个可诱导系统会具有即时翻译相关性来作为一种资源研究唐氏综合症中受到影响的细胞病理学和基因途径,并以一种在个体之间、亚克隆之间甚至同基因分离物之间都可能存在的普遍遗传性或表观遗传性变异但在我们研究的系统中不存在的方式。
在哺乳动物雌性(XX)和雄性(XY)间存在一种自然的机制来补偿X-关联基因拷贝的差异。这一作用是由一个大片段(人体中为约17kb)非编码RNA,XIST,所驱动,XIST只从非活性X染色体中产生并“漆盖”(针对性积累)分裂间期的染色体结构。在早期发育过程中,XIST的RNA诱导大量异源染色质的修饰作用以及结构性变化,这些变化转录性地沉默非活性的X染色体并在细胞中将其显示为浓缩的巴氏小体(Barrbody)。有证据显示某些DNA序列对于XIST功能具有特异性,因为确实有一些人的基因逃脱了X-失活作用;然而,常染色体染色质确实具有被沉默的能力。而对于要沉默的一个常染色体的全部可能的理解则需要在避免制造一个有害的具有功能性的单体性条件下检测。我们在此所做的满足这一要求,并建立了一个可追踪的模型来研究人染色体失活作用的特异生物学内容。
XIST插入到三体性21号染色体
由于其体积巨大,无论是XIST基因还是cDNA,以前都没有以针对性方式被整合过。因此,我们的第一个目标是证实ZFNs能够准确地插入迄今最大的转基因,它要比基因组编辑常用的序列大得多。我们首先使用~16kb的XIST转基因在转化细胞系(HT1080)中进行这种尝试,使用已建立的ZFNs将转基因在19号染色体AAVS1位点上插入。这次尝试非常成功。为将这一方法扩展到21号染色体上,我们将ZFNs插入到染色体21Q22的DYRK1A位点上内含子1中36个碱基的序列中并验证了活性(补充图1a,b)。我们在HT1080细胞中对于更大的含有接近XISTcDNA全长的构建物(~21kb)进行了检验并证实了在这一富含基因区域目标片段有效准确的插入(补充图2a,b)。
我们接着确定这一方法是否适用于技术上要求更高的诱导性万能干细胞,因为它具有独特的治疗潜能以及发育成各类细胞的能力,因此对于任何将来离体性(exvivo)细胞治疗工作都将具有重要意义。我们使用一个男性唐氏综合症衍生的iPS细胞株,我们对这一细胞株的万能性标记物以及21号染色体的三体性都进行了证实。虽然我们可以使用一个持续性转录的转基因,为达到最大限度的利用,我们在研究唐氏综合症生物学性质时使用了一个可以诱导的系统。只用了一步,我们就将强力霉素(doxycycline)控制的XIST转基因整合在21号染色体上(图1b,补充图3a)还有携带强力霉素对照组分(rtTA)的转基因整合在91号染色体AAVS1的安全位点,插入不产生任何已知的副作用(补充图3b)。
我们通过分裂间期RNA/DNA荧光定位(insitu)杂交(FISH)的方法对从汇集的转化后株系中的245个克隆进行了分析(图1c)来确定XIST是否存在及覆盖三个DYRK1A等位基因之一。值得注意的是98.5%的XISTRNA阳性克隆在21号染色体这一位置携带XIST,而且还含有rtTA/选择性转基因(补充表1)。有效性足够高,以致于在修饰作用到编辑条件期间,我们获得的几个亚克隆中XIST整合到两个甚至所有三个DYRK1A等位基因上(参见方法,补充图3c,补充表1)。基于以下特征有六个彼此独立的亚克隆选作进一步研究使用,选择基于:三个21号染色体中的一个具有XIST转基因;万能性克隆形态;OCT4(亦称POU5F1)染色(图1d,补充图4a)以及生成胚状体的能力。分裂中期染色体的FISH检测(图1e,补充图3d)和Southern印迹(补充图1c-e)确定了对于所有六个克隆每一个的47条染色体来说基因插入的准确性。对于选定的克隆进行的高分辨率细胞遗传学显带及/或点阵可比较基因组杂交的
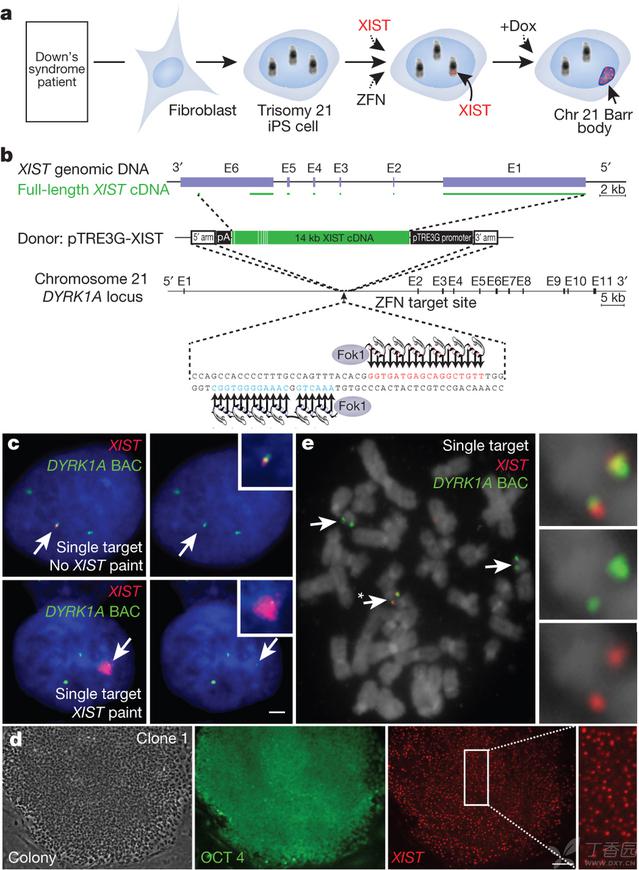
自然的非活性X染色体会形成携带抑制性组蛋白标记物的浓缩的巴氏小体(Barr body)。与此相似,在XIST被诱导5天后,被编辑过的21号染色体开始明显增加所有检测的异源染色质标记物,包括H3K27me3、UbH2A和H4K20me在90-100%的细胞中,而且在稍后的阶段还包括macroH2A(图2a,b,补充图5a)。补充图5b描述了H3K27me在分裂间期整个21号染色体上呈扩散的状态。还有在许多细胞的细胞核中21号染色体变成容易被注意到的浓缩态,进一步证实了我们成功地产生出异源染色质类型的21号染色体巴氏小体(图2c)。
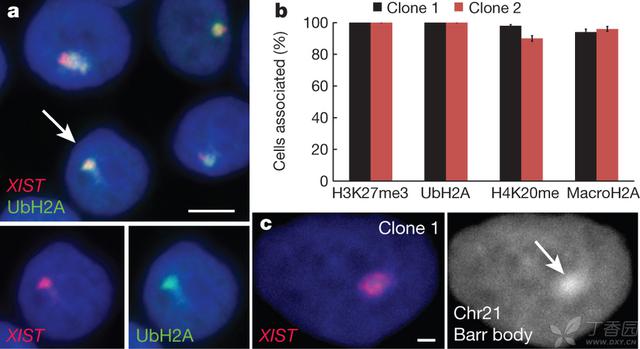
Figure 2 | XIST induces heterochromatin modifications andcondensed chromosome 21 Barr body.
a, XIST RNA recruits heterochromaticepigenetic marks (for example, UbH2A). Channels are separated for cellindicated with an arrow. Scale bar, 5 mm.
b,Percentage of XISTterritories withheterochromatin marks. Mean±standard error, 100 nuclei in~5 colonies.
c, XISTRNAinduces chromosome 21 Barr bodyvisible by DAPI stain (arrow). Scale bar, 2 mm.
图2 XIST诱导异源染色质修饰作用并产生浓缩的21号染色体巴氏小体
a,XIST的RNA征募异源染色体类表观遗传性标记物(如UbH2A)。对于细胞的各分开的通道使用箭头标明。比例尺为5um。
b,XIST范围内带有异源染色质标记物的百分比。均值±标准误,5个克隆中检测了100个细胞核。
c,XIST的RNA诱导产生的巴氏小体在DAPI染色下的情况(箭头)。比例尺为2um。
在21号染色体上的基因特异性沉默作用
为了对XIST针对性的21号染色体整体转录的情况进行检测,我们使用了一种我们建立的广泛检测异源核RNA(hnRNA)表达及分辨活性和非活性X染色体的方法,这一方法基于对于CoT-1重复RNA的原位杂交。通过CoT-1检测显示出21号染色体的对于hnRNA的XIST的RNA领域缺失(补充图5c),这一现象与非活性X染色体相似。
我们接着使用多颜色RNA-FISH方法对6个特异的21号染色体基因中的每个基因确定其转录焦点的存在,一种以前我们使用过的方法可以分辨出非活性X染色体上活性基因和被沉默了的基因。在没有XIST表达时,每一个DYRK1A基因有三个明亮的转录焦点(图1c,顶部图),但XIST表达后,针对性的基因变得很弱或检测不到,说明DYRK1A受到抑制作用(图1c,底部图)。
21号染色体上的APP基因编码β-淀粉样前体蛋白,APP中的突变会产生β-淀粉样蛋白的积累最终导致早发的家族式阿兹海默症,并且APP的过量表达于阿兹海默症特性的唐氏综合症相关。起初,三个明亮的RNA转录焦点明显可见(图3a,顶图)。短期XIST的表达会导致目标基因的不完全性抑制(图3a,中图),而20天后会完全抑制,在两个独立的克隆中可见(图3a,b)。
我们又对其他4个基因位点进行了检验,它们距XIST为3-21Mb,这些基因是:ITSN1、USP25、CXADR和COL18A1。在所有积累XISTRNA的细胞中编辑过的21号染色体上的这些基因都被完全沉默了(图3c,d,补充图6a)。使用单核苷酸多样性分析方法(SNP)对基因特异性沉默作用进行了进一步的核实。使用反转录产物对8个已知的多样性位点(4个基因)进行PCR并测序(ADAMTS1、ETS2、TIAM1和HSPA13)(补充图6b,c)。有意思的是,2号和3号克隆显示完全相同的8个SNP被抑制的模式,而1号克隆显示另一种SNPs被抑制的模式。正如在补充图6c中概括的那样,这一染色体范围的模式可以对三个21号染色体同源物的每个单倍体进行外推归纳,从而间接地对21号染色体被XIST转基因沉默的每个克隆进行确证。
我们还对携带两个或三个XIST拷贝的21号染色体的克隆进行了检测,并发现在使用强力霉素诱导20天后,大多数细胞失去了XIST的定位或表达,而且目标染色体没有沉默APP基因(补充图7a,b)。因此,为克服产生功能性单倍体或缺对染色体这一问题,需要进行体外的筛选和表观遗传性的适应过程,这与观察到的在嵌合体病人体内单倍体细胞不能持续的现象相一致。
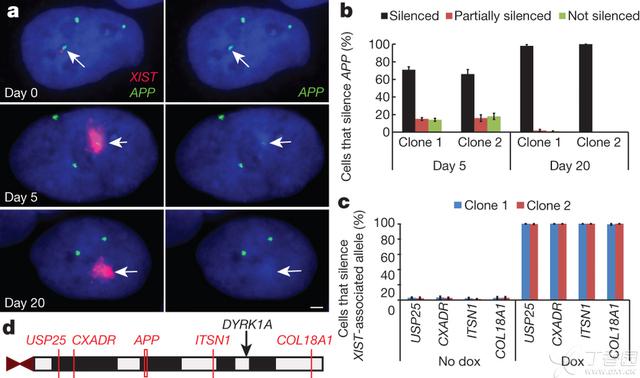
Figure 3 | XIST induces long-range silencing in targetediPS cells.
a,RNA FISH. APP RNA transcribes from three loci inuninduced cells (day 0), and is progressively silenced after induction(targeted chromosome 21, arrows). Scale bar, 2 mm.
b,Quantification of APPsilencing. Mean±standard error, 100 nuclei.
c, Silencingfor four more chromosome-21-linked genes by RNA FISH. Mean±standard error from 100 nuclei.
d, Long-range silencing of chromosome21 genes by XIST RNA. USP25 is~21Mb from the XIST integration site (black arrow).
图3 XIST在目标iPS细胞中诱导大范围的沉默效应
a,RNAFISH。在未诱导的细胞中(0天)三个基因位点的APP基因RNA转录物,诱导后逐渐被沉默(针对21号染色体,箭头所示)。比例尺为2mm。
b,APP沉默的定量分析。均值±标准误,100个细胞核。
c,RNA FISH检测对于21号染色体上4个基因的沉默效果。均值±标准误,100个细胞核。
d,XIST的RNA对于21号染色体大范围的沉默效果。USP25基因距离XIST的整合位点约为21Mb。
基因组范围的沉默作用和甲基化作用
当我们完成了对于10个基因的基因特异性抑制的验证后,我们扩展到对整个基因组范围的表达特性的检测。我们对三个转基因克隆及其亲本株系使用强力霉素处理3周,然后将它们的转录物与没有XIST转录的平行培养物进行比较,每个样本三重重复。在所有三个克隆中只有21号染色体发生了非常大的改变,其95%显著性表达的基因被抑制了(图4a,补充表2)。
剂量补偿作用将21号染色体的表达校正到接近正常二倍体的水平,基于XIST被诱导后每个染色体表达基因总输出量的变化。由于有证据表明在三体性细胞中许多21号染色体基因并没有到理论上1.5倍的水平,我们还直接将三体性细胞与二倍体细胞进行了比较。这一结果为评价由XIST校正21号染色体过量表达的程度提供了一个基线。XIST诱导后,在1号、2号和3号克隆中21号染色体的表达分别减少了20%、15%和19%;这与没有第三条21号染色体的二倍体iPS细胞整体上减少的22%非常接近(图4a)。这一二倍体株系具有代表性,因为我们从三体性亲本iPS细胞中分离得到的同基因性二倍体亚克隆所产生的变化为21%。由XIST抑制的单个基因分布在21号染色体各个区域,就像与二倍体细胞比较的三体性细胞中过量表达的基因那样(图4b)。此外,qRT-PCR证实了各个检测的基因的抑制(补充图7c)。很清楚,在三体性细胞中,XIST对于大多数21号染色体上过量表达的基因诱导产生出稳定的剂量补偿作用。
21号染色体的三体性可能对基因组范围的表达途径有影响,但21号染色体的三体性的作用会与遗传性及表观遗传性变异相混淆。我们这种可诱导的三体性沉默系统为解决这一重要问题提供了一个新的立足点。比如,即使三个等基因性的转基因亚克隆显示出许多表达差异(>1000),但通过XIST诱导作用,大约在所有三个克隆中只有200个基因有变化(不是在强力霉素处理的亲本株系中),大多数是由于21号染色体的三体性直接造成的。因此,“三体性培养皿校正”有希望作为一种方法来确认由于21号染色体三体性干扰的基因组范围内的途径。
除了转录沉默外,X-失活作用会通过启动子CpG岛过度甲基化而得到稳定,启动子CpG岛过度甲基化在沉默过程的晚些时候发生。因此,我们也在XIST诱导3周后在两个基因组编辑过的克隆中检测了甲基组启动子,并没有发现它发生什么变化,只有一个例外,就是21号染色体的基因例外(P<2.2X10-16)(图4c)。在21号染色体上,97%的CpG岛包含的基因在启动子DNA甲基化方面显示出稳定的增加,在我们所见到的非活性X染色体的范围内(根据活性/非活性染色体进行调整,参见方法)。这种变化席卷整个染色体,只是在这两个克隆中有几个有意思的例外基因“逃脱”了这种甲基化作用。
综上,8种不同方法得出的数据证实对于一个参与X染色体沉默的RNA,大多数21号染色体上的基因的回应是经历表观遗传性修饰作用并被沉默。
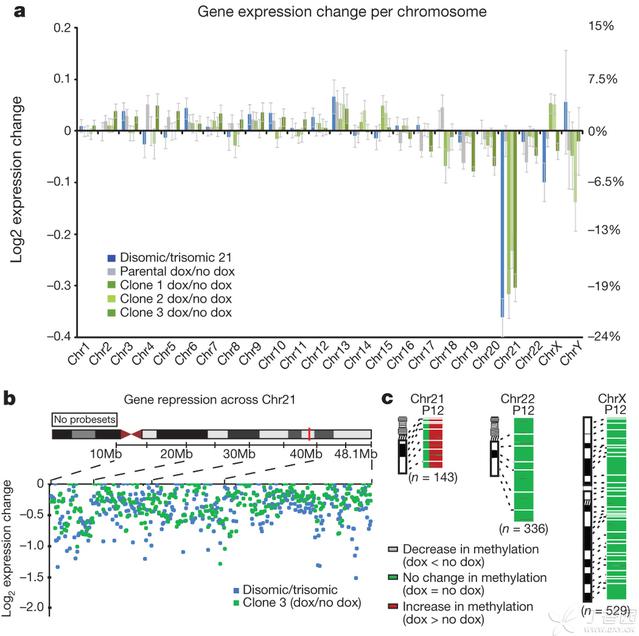
a,Microarray: expression difference for three transgenic clones in doxycycline(dox) versus no doxycycline, compared to disomic line versus trisomic parentalline. Total change in gene expression (n=3) per chromosome shows chromosome21 ‘correction’ near disomic levels, with only limited changes on otherchromosomes. The right yaxis is scaled for percent gene expression change. Mean±standard deviation, in triplicate.
b,Distribution of individual gene repression across chromosome 21.
c, Methylation of CpG islandpromoters. In treated clones, 97% of chromosome 21 genes increased by at least5% (2-fold greater than average), compared to none in the parental line. P,parental line; 1, clone 1; 2, clone 2.
图4 基因组表达及甲基化作用揭示21号染色体上广泛性的沉默作用
a,微点阵:三个转基因克隆在有无强力霉素处理时表达的差异,与二倍体株系与三体性亲本株系之间差异的比较。每个染色体上基因表达总的变化显示出“校正”21号染色体接近二倍体水平,而其他染色体变化很有限。右侧y轴表示基因表达改变的百分率。均值±标准误,三重重复。
b,21号染色体上单个基因抑制作用的分布情况。
c,CpG岛启动子的甲基化作用。在处理的克隆中,21号染色体上97%的基因增加了至少5%(比平均值大两倍),与未处理的亲本株系比较。P,亲本株系;1,1号克隆;2,2号克隆。
体外水平的表型校正
染色体不平衡剂量补偿显示出一种新的模式,使我们有机会推动唐氏综合症的研究在多个方向上的进步,包括使用新方法来研究人的唐氏综合症细胞病理学,这是目前我们所未知的内容。对于三体性完全相同的细胞平行培养中的一个进行三体性沉默作用的诱导,会揭示出由于21号染色体的三体性造成的细胞病理学特性,这种特性会由于细胞分离之间的差异而很难分辨。我们对于细胞的增殖以及神经丛的形成情况进行了检测,从而了解三体性对细胞表型的影响。
唐氏综合症患者大脑中有一些证据显示增殖性受到了损伤,然而,我们观察到的是在我们的唐氏综合症的成纤维细胞样本之间的增殖性变化不定,表现出对培养历史高度的敏感性。将完全相同的细胞培养置于有或无强力霉素条件下1周,答案清晰明了。在6个独立的转基因亚克隆中进行的XIST诱导作用很迅速,并仅在7天内就会稳定持续地形成更大、更多、更致密的克隆(图5a,补充图8a),大约多18-34%的细胞(图5b)。强力霉素本身并没有增加唐氏综合症亲本细胞或亚克隆生长的能力(图5b,补充图8a)。因此,由于21号染色体过量表达相关的增殖性损伤会很快通过剂量补偿而减轻。
我们接着对目标针对性的唐氏综合症iPS细胞向神经性前体细胞的分化情况进行了检测。对长满的而且进行了神经性分化诱导处理11-12天的培养物,所有三个XIST表达的培养物都开始形成神经丛,而且经过1-2天会在培养物中充满神经玫瑰花状结构(neuralrosettes,也可视为神经丛),这是一种神经前体细胞特征(通过PAX6和SOX1染色确定)(补充图8b)。值得注意的是,甚至在第14天,平行的未诱导培养物中也没有出现玫瑰花状结构(图5c)。没有进行校正的培养物需要另外4-5天才能在神经性诱导培养基中长满类似数量和大小的神经玫瑰花状结构即它们在第17天完成(图5d,补充图8d)。在亲本株系中显示强力霉素对神经生成没有任何效应(图5c,d,补充图8d)。在神经分化方面这种明显的滞后似乎与细胞的增殖性之间主要呈非依赖性关系。在各种iPS细胞株之间神经性分化动力学的差异会由于21号染色体的三体性而变得不清楚。我们使用平行培养和响应式21号染色体沉默的方法来克服这一困难,使这些重要的表型类差异变得清楚。这一点强调了这种新实验模型可能用以阐明由21号染色体过量表达直接导致的在iPS细胞中以及它们分化的后代中的细胞病理学特征。
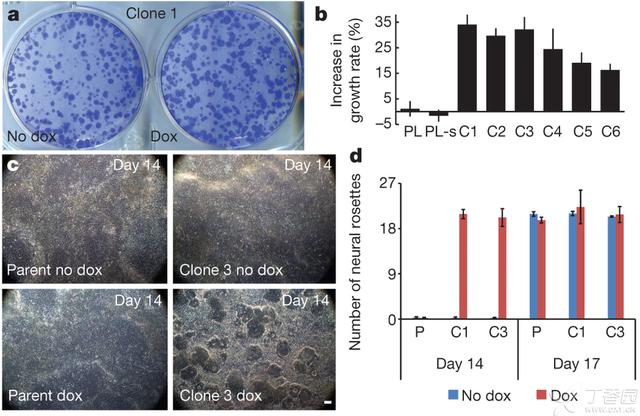
Figure 5 ‘Trisomycorrection’ affects cell proliferation and neurogenesis.
a,One week of XIST expression resulted in larger, morenumerous colonies (representative sample).
b,Changes in cell number for parental line (PL), parental line subclone (PL-s),and six transgenic clones (C1–C6). Mean±s.e. (n=4–6).
c,Corrected cultures formed neural rosettes by day 14; trisomic (parental andnon-induced) cultures took longer (17 days). Scale bar, 100 um.
d, Number of rosettes formed on day14 and day 17. Mean±standard error, 10–12 random fieldsin triplicate. P, parental; C1, clone 1; C3, clone 3.
图5 “三体性校正”对细胞增殖和神经生成的影响
a,XIST表达一周导致更大、更多克隆的形成(代表性样本)。
b,在亲本株系(PL),亲本株系亚克隆(PL-s)以及六个转基因克隆(C1-C6)中细胞数量的变化。均值±s.e. (n=4-6)。
c,校正后的培养物在第14天形成神经玫瑰花状结构;三体性(亲本及未诱导)培养物所花时间要长(17天)。比例尺为100um。
d,神经玫瑰花状结构在第14天和第17天形成的数量。均值±s.e. 均值±s.e.,10-12个随机视野,三重重复。P,亲本;C1-克隆1号;C3-克隆3号。
未来应用情况
补充信息对于与应用可能性及治疗策略相关的两个重要的观点进行了概述。首先,我们显示异源染色质沉默作用可以稳定维持,即使在去除强力霉素和XIST表达的条件下(补充图9a,b),这一点与以前的研究结果相一致。其次,虽然没有进行大量的研究,但我们针对来自女性唐氏综合症患者的非永生化成纤维细胞进行了XIST处理,并得到了许多在21号染色体上携带XIST(以及一些异源染色质标记物)的细胞(补充图9c,d)。最后,我们注意到我们的XIST转基因缺乏X染色体“计数”序列,因此这种方法可以用于女性X染色体的失活作用。
讨论
我们计划将X染色体剂量补偿的基本生物学原理与染色体剂量疾病,特别是唐氏综合症的病理性特征联系起来。这样,我们现在的研究所产生的结果在三个重要的领域内具有影响:一个在基础研究,两个在应用领域。
虽然并不是我们主要的研究焦点,但我们工作产生的一个显著性影响在于我们创造了一个可追踪、可诱导的系统来研究人染色体的沉默作用。重要的是,与随机整合到二倍体细胞不同,沉默一个三体性常染色体避免了针对所有常染色体沉默的筛选,并且这一方法令人惊讶地证实了21号染色体被沉默的稳定能力。因此,为X染色体而进化的XISTRNA使用了表观基因组范围的机制。可以将单个XIST转基因插入到任何位点的能力为研究XIST的功能提供了一个更强大的工具,而我们的研究结果也几乎将能用于宿主其他方面应用的针对性转基因的大小提高了三倍。
从应用的方面看,三体性沉默作用会马上作为一种新方法对唐氏综合症中失调的未理解的细胞途径的研究产生影响,并产生机会来衍生并研究各种可能与唐氏综合症治疗相关的患者适用的细胞类型。体外的可诱导三体性沉默作用与未沉默完全相同的培养物相比较,可以获得更强的差异性辨别能力,这些差异性是由于21号染色体过量表达直接造成的,这与其它方式造成的差异性有所不同,其他方式指包括在转基因亚克隆之间或者从三体性中分离出的甚至更罕见的二倍体亚克隆之间的遗传性和表观遗传性变异。XIST的表达不仅促进21号染色体的抑制,而且对于基因组表达特征具有一定的限制作用,并反转了细胞增殖及产生神经前体的缺陷,这对于唐氏综合症患者脑部细胞过少的现象具有意义。这一新的方法可以弄清楚在唐氏综合症中一直受到影响的基因群和相关的途径,使可能重新平衡那些途径及细胞病理特征的药物寻找具有明确的目的。这一普遍性的策略可以扩展来对于其他染色体疾病进行研究,如13号和18号染色体三体性疾病,患者通常在1-2岁即夭亡。
最后,这一工作最具有前瞻性的意义在于将唐氏综合症引入到将来基因治疗研究的考虑范围之内。虽然对于任何临床基因治疗的研制都是一个多步骤的进程,但任何项目都需要第一步,在活细胞中将潜在的遗传性缺陷完成功能性校正达到了第一步的要求。我们已经证实了在唐氏综合症中对于染色体不平衡不再是无法解决的问题。我们的希望是对于患有唐氏综合症的家庭和个人来说,在此证实的原理论证,对于过去50年在基础X染色体生物学方面取得的进展,在与应用相关的方面,开启了多条新的大道。(全文完)
作者:姜博士
来源:自然杂志
中国智力残疾人及亲友协会 China Association of Persons with Intellectural Disability and their Relatives
地址:北京市西城区西直门南小街186号 邮编:100034 电话/传真:010-66580064 电子邮箱:zhgzxbgs@163.com zbl47331@sina.com
中国智协 版权所有 Copyright © 2014 CAPIDR,All Rights Reserved 京ICP备13052643号-1 网站建设:北京传诚信